FDA publica revisión positiva de la vacuna Pfizer
Confirman que la vacuna protege en un 95% contra COVID-19
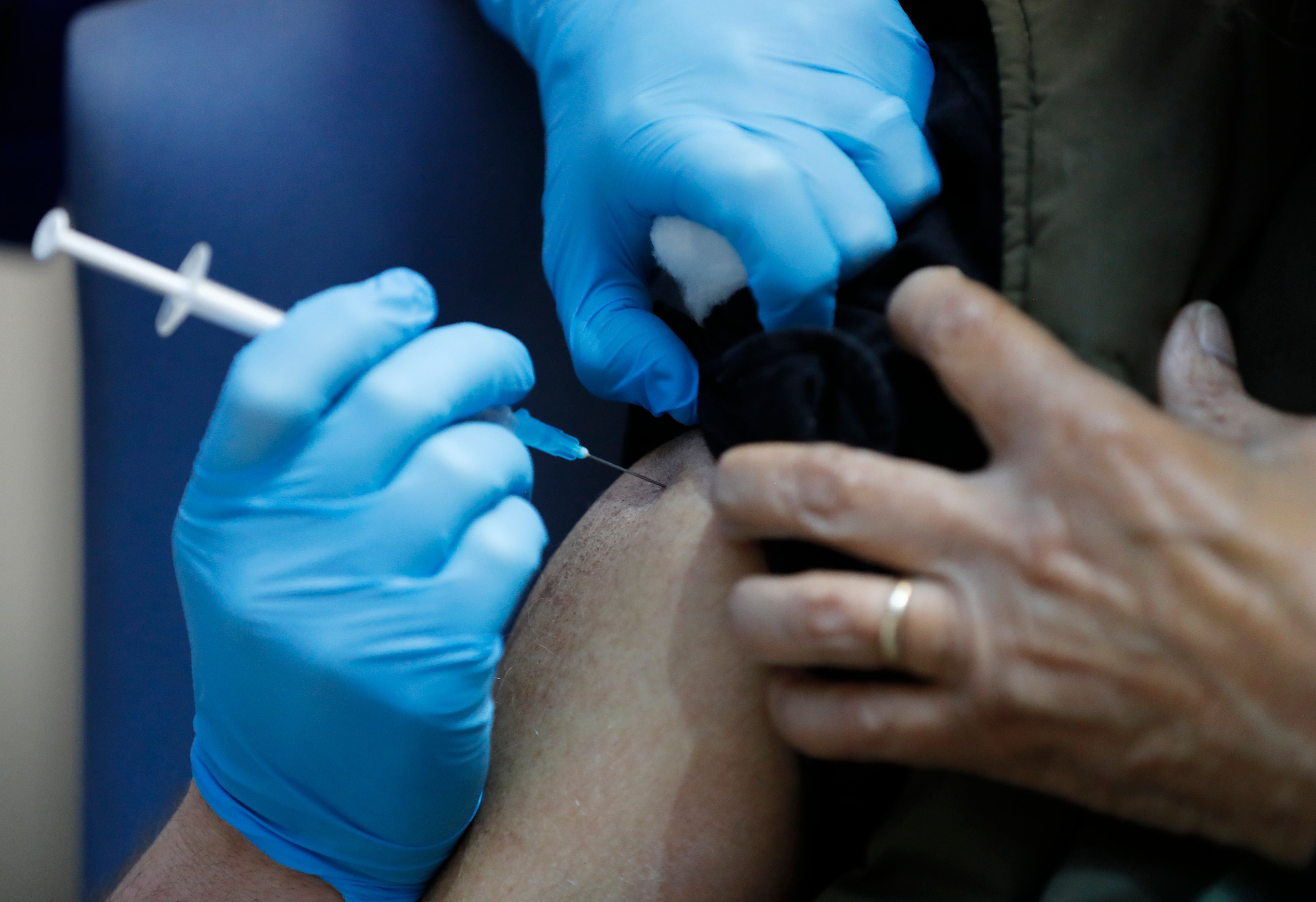
Los documentos publicados por los reguladores estadounidenses este martes confirmaron que la vacuna COVID-19 de Pfizer y BioNTech protegía fuertemente contra el COVID-19, ofreciendo la primera mirada a la evidencia detrás de las vacunas.
La Administración de Alimentos y Medicamentos (FDA por su siglas en inglés) publicó su análisis en línea, incluso al otro lado del Atlántico, Gran Bretaña comenzó este martes a vacunar a sus ciudadanos más viejos con las inyecciones de Pfizer-BioNTech.
Pero los Estados Unidos juzgan las vacunas experimentales de una manera única: el jueves, la FDA convocará un tribunal científico que debatirá, en público y en vivo, qué tan sólidos son los datos que respaldan las vacunas.
Un panel de científicos independientes analizará la revisión de primer paso de la FDA antes de recomendar si la vacuna parece lo suficientemente segura y efectiva para millones de estadounidenses.
Se espera que la FDA, que normalmente sigue los consejos del comité, emita una decisión en los días posteriores a la revisión. Si se les da luz verde, los primeros beneficiarios serían los trabajadores de la salud y los residentes de hogares de ancianos de acuerdo con los planes establecidos por cada estado.
Pfizer y su socio alemán BioNTech informaron anteriormente que las inyecciones parecen tener un 95% de efectividad para prevenir la enfermedad COVID-19 de leve a grave en un gran estudio en curso. Ese resultado se basa en las primeras 170 infecciones detectadas. Solo ocho de las infecciones se produjeron entre voluntarios que recibieron la vacuna real, mientras que el resto recibió una inyección simulada.
Eso se midió poco después de que los participantes del estudio recibieran su segunda dosis. Aún se desconoce cuánto durará esa protección. "Estamos buscando los mejores datos posibles", advirtió recientemente el Dr. Paul Offit del Hospital del niño de Filadelfia y asesor de la FDA. "La gente se preocupa, razonablemente, ¿qué tal seis meses después?"
El otro tema crítico fue la seguridad. Pfizer no ha informado de efectos secundarios graves. Algunos receptores experimentan reacciones similares a las de la gripe, como fiebre, fatiga o dolores musculares, especialmente después de la segunda dosis requerida. Es una señal de que el sistema inmunológico se está acelerando, capaz de reconocer y defenderse si aparece el virus real.
Otras preguntas en la lista de asesores de la FDA:
- ¿Qué tan bien protegen las vacunas a las personas de alto riesgo, como las mayores de 65 años o las de cualquier edad con problemas de salud adicionales como obesidad o enfermedades cardíacas?
-¿Las vacunas fueron probadas adecuadamente en comunidades negras, hispanas y otras comunidades más afectadas por la pandemia, para saber qué tan bien funciona la vacuna en esas poblaciones?
- ¿La vacuna protege contra una infección asintomática, o los vacunados aún pueden propagar el virus sin saberlo?
-¿Qué se les debe informar a las mujeres embarazadas sobre la vacunación, ya que no fueron evaluadas en el estudio de Pfizer?
Los estudios en niños de tan solo 12 años recién comienzan.
Las vacunas de emergencia podrían comenzar antes de que se complete el estudio de 44,000 personas de Pfizer, y responder algunas de esas preguntas requerirá que continúe ese estudio. Las autoridades sanitarias están luchando por encontrar la forma de hacerlo de una manera justa para los receptores de placebo que, con razón, desearían recibir la vacuna real.
Ese acceso "es lo más importante para muchos", escribieron recientemente Pfizer y BioNTech a los participantes del ensayo. Las compañías dijeron que están explorando formas de permitir que los receptores de placebo pasen al grupo de la vacuna una vez que cumplan con los criterios de elegibilidad para el acceso temprano, si son trabajadores de la salud, por ejemplo, o cuando se abre la línea para otros trabajadores esenciales o personas mayores de 65 años.
En el frente de la seguridad, los voluntarios del estudio serán monitoreados durante dos años, pero incluso los estudios de decenas de miles de personas no pueden detectar una complicación que solo afecte a 1 en un millón. Por lo tanto, el gobierno también se está preparando para un monitoreo sin precedentes de los receptores una vez que comiencen las vacunas de emergencia.


Bookmark popover
Removed from bookmarks